Biokatalizators Sulfīta oksidāze izraisa toksisku sēra savienojumu pārvēršanu no aminoskābju sadalīšanās netoksiskos sulfātos.
Tas ir vitāli svarīgs, tāpēc rodas visos organismos. Ja tā darbību traucē ģenētisks defekts, rodas sulfīta oksidāzes deficīts. Pārmērīgi lielam sulfīta saturam asinīs var būt negatīva ietekme arī uz veseliem pacientiem.
Kas ir sulfīta oksidāze?
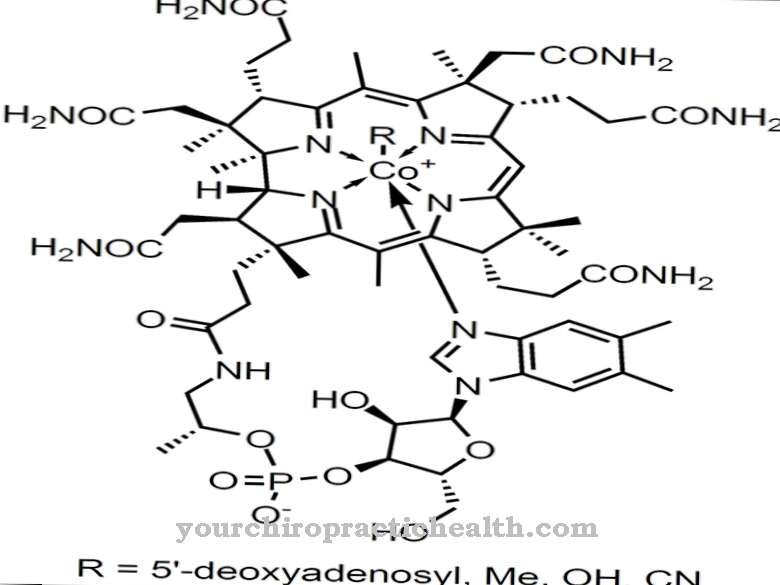
Sulfīta oksidāze (gēna nosaukums: SUOX) ir molibdēnu saturoša enzīma nosaukums, kas sastāv no 466 aminoskābēm. Tas pieder ksantīna dehidrogenāžu saimei un sastopams gandrīz visos organismos. Tās centrā ir molibdēns, kas ir svarīgs mikroelements.
Metāls tajā bioloģiski pieejamā formā ir kā molibdāta anjons. Sulfīta oksidāze to izmanto kā kofaktoru (molibdāta-molibdopterīna savienojums). Ferments pārvērš sēru saturošās aminoskābes metionīnu, cisteīnu utt., Kas tiek uzņemtas ar pārtiku, nekaitīgos sēra sāļos (sulfātos), kas pēc tam izdalās ar urīnu. Zīdītājiem sēru noārdošais biokatalizators galvenokārt notiek aknās un nierēs. Enzīms sulfīta oksidāze nodrošina skābekļa koncentrāciju asinīs un neaizvietojamās aminoskābes un citas sēra vielas.
Atbrīvotos elektronus izmanto elektronu transportēšanas ķēdē, lai iegūtu ATP (adenozīna trifosfātu). Ferments katru dienu katalizē 10 reizes lielāku sulfītu daudzumu vienā litrā alkohola.
Funkcija, efekts un uzdevumi
Ikviens patērē sēru saturošus proteīnus un pārtikas piedevas. Pēdējie ir marinēti dārzeņi, greipfrūtu sula utt., Un tie ir paredzēti, lai aizsargātu ēdienu no mikrobu invāzijas un krāsas maiņas. Tie veido pušķu vielas vīnā.
Tikai cisteīna sadalīšanās rezultātā organismā katru dienu rodas 1680 mg toksiska sulfīta, kas nekavējoties jāpārvērš sulfīta oksidāzes laikā, lai netiktu bojāti orgāni un audi. Ferments darbojas kopā ar citiem biokatalizatoriem. Sulfīti ir indīgi un var iznīcināt organismā dzīvībai svarīgas vielas un pat mazākā daudzumā nomāc nepieciešamos vielmaiņas procesus. Lai varētu veikt svarīgo šūnu detoksikāciju, sulfīta oksidāzei nepieciešams mikroelements molibdēns.
Šī metāla trūkums var izraisīt nopietnas sekas. Pārāk augsts dzīvsudraba līmenis organismā var arī kavēt sulfītu oksidāzes funkcionalitāti.
Izglītība, sastopamība, īpašības un optimālās vērtības
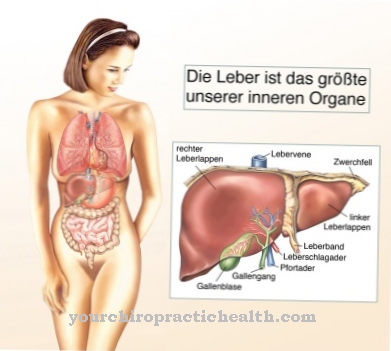
Sulfīta oksidāze galvenokārt tiek ražota mitohondrijos, šūnu "enerģijas centros". Piemēram, žurkām 80 procenti no tā rodas aknu šūnu mitohondrijās. Turklāt tas joprojām ir spēcīgi pārstāvēts nieru šūnās.
Molibdēna oksīds, kas nepieciešams sulfīta oksidāzes darbībai, atrodas enzīma aktīvajā centrā. Kā nesen atklāja zinātnieki, molibdēna trioksīda nanodaļiņas to var aizstāt pacientiem ar molibdēna deficītu. Viņiem ir līdzīga katalītiskā iedarbība organismā kā dabiskajam fermentam. Tādā veidā varēja ārstēt iepriekš letālas slimības, piemēram, sulfocisteinūriju.
Slimības un traucējumi
Trūkums sulfīta oksidāzes gadījumā var izraisīt astmatiskas un pat anafilaktiskas reakcijas veseliem cilvēkiem, jo parasimpātiskā nervu sistēma ietekmē mastu šūnas, kas ir atbildīgas par alerģiju attīstību.
Turklāt, ja sulfīta oksidāzes līmenis ir pārāk zems, tas var izraisīt smagu nogurumu, galvassāpes un zemu cukura līmeni asinīs. Ģenētiskajam vitālajam fermentam ir vēl sliktākas sekas. Jaundzimušais ir piedzimis ar fiziskām kroplībām un garīgiem traucējumiem. Šis tā saucamais sulfīta oksidāzes deficīts vai sulfocisteinūrija rodas kā molibdēna kofaktora (MoCo) deficīta slimība aptuveni 100 000 līdz 500 000 dzemdību laikā. Zīdaiņiem, kas cieš no izolēta sulfīta oksidāzes defekta, ir līdzīgi simptomi: smaga encefalopātija, tik tikko kontrolējami krampji, spastiskums, mikrocefālija, muskuļu relaksācija un progresējoša smadzeņu atrofija.
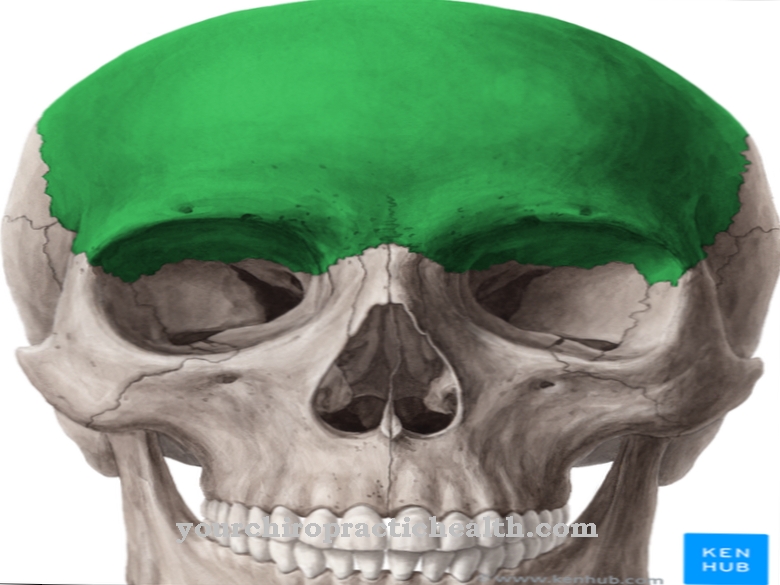
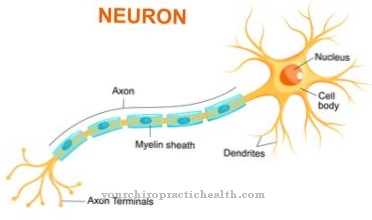
Tā kā autosomāli recesīvo iedzimto enzīmu deficīta slimību pašlaik nevar efektīvi ārstēt, mazie pacienti parasti mirst bērnībā: sēra savienojumi, kas nav sadalīti, saindē neironus un centrālās nervu sistēmas mielīna apvalkus un uzkrājas šūnu audos. Jau pēc dzimšanas ir problēmas ar ēšanu un kuņģa satura vemšanu. Zīdaiņi piedzimst ar deformētu galvaskausu (izvirzītu pieri, dziļi iestiprinātām acīm, pārmērīgi gariem plakstiņiem, biezām lūpām, maziem deguniem). Pirmajos dzīves mēnešos objektīvs acīs mainās.
Apmēram 75 procentus līdz šim aprakstīto sulfocisteinūrijas gadījumu izraisa MoCo deficīts: Visi trīs fermenti, kas iesaistīti sēra sadalīšanā organismā, sulfīta oksidāze, ksantīna oksidāze un aldehīda oksidāze, uzrāda ievērojami samazinātu aktivitāti. Izolētā sulfīta oksidāzes deficīta iemesls ir SUOX gēna mutācija (12. hromosoma). Tas parādās trīs variantos: A tips (mutācija MOCS1 gēnā), B tips (MOCS2 gēns) un C tips (MOCS3 gēns). A tipa mutācija ir visizplatītākā. Preparāta molekulas cPMP veidošanās tiek kavēta. Tomēr tagad vielu var ražot un ievadīt laboratorijā.Lai uzlabotu bērnu pacienta izdzīvošanu, pēc iespējas ātrāk jā diagnosticē deficīta slimība un jāārstē ar molibdāta ikdienas intravenozu ievadīšanu.
Tādā veidā var vismaz vēl vairāk sabojāt. Bērnam tiek nozīmēti spazmolītiski medikamenti pret krampjiem. Viņiem jābūt arī diētai ar zemu olbaltumvielu daudzumu. Alternatīvi var ievadīt arī MoCo prekursoru Z. Tas samazina krampjus un novērš turpmākus smadzeņu bojājumus. Medicīnā ir lielas cerības uz iepriekš neārstējamās slimības ārstēšanu ar molibdēna trioksīda nanodaļiņām, kas organismā uzņemas sulfīta oksidāzes lomu. Lai noskaidrotu, vai nedzimušajam bērnam ir sulfīta oksidāzes deficīts, grūtniecei var pārbaudīt S-sulfocisteīna līmeni amnija šķidrumā.

.jpg)





.jpg)




.jpg)