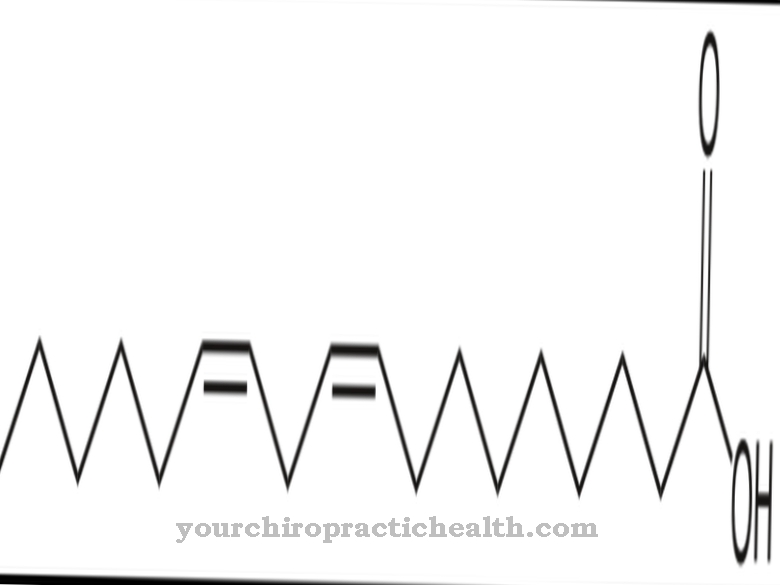
Hidroksilizīns ir ne-klasiska olbaltumvielu aminoskābe. Tas tiek iekļauts atbilstošajā olbaltumvielā kā lizīns un ar enzīma palīdzību hidrolizēts līdz hidroksilizīnam polipeptīdā. Tas ir viens no galvenajiem kolagēna olbaltumvielu komponentiem saistaudos.
Kas ir hidroksilizīns?
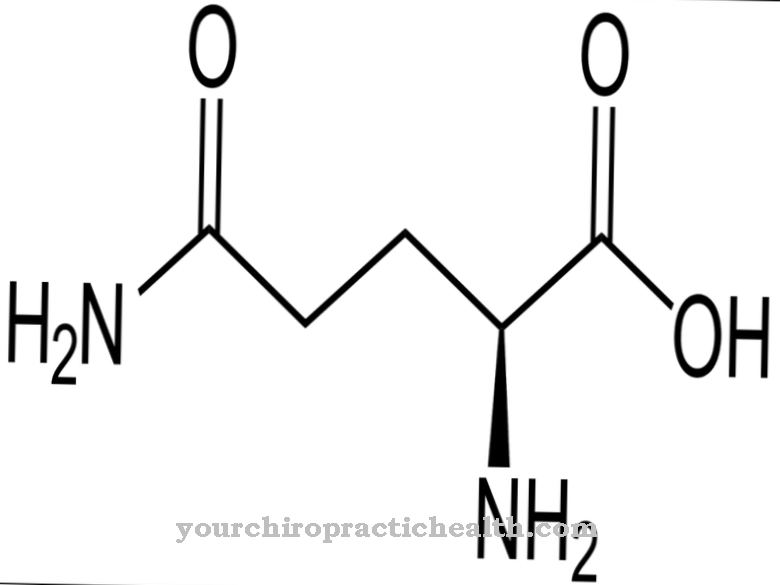
Hidroksilizīns ir proteinogēna aminoskābe, kas vispirms tiek iekļauta olbaltumvielās kā lizīns. Tāpēc tā ir nekanoniska proteinogēna aminoskābe. Termins "kanonisks" nozīmē klasisko.
Tātad šai aminoskābei nav kodona. Hidroksilizīns galvenokārt atrodams saistaudu kolagēnā un glikoproteīnos. Tur lizīns fermentatīvo procesu rezultātā tiek pārveidots par hidroksilizīnu. Tikai daļa no lizīna tiek pārveidota par hidroksilizīnu. Attiecīgo kolagēnu īpašības ir atkarīgas no hidrolizētā lizīna un prolīna atlikumu daudzuma.
Hidroksilizīnu var izdalīt brīvā formā kā hidrohlorīdu. Hidroksilizīna hidrohlorīds ir smilškrāsas pulveris ar kušanas temperatūru no 225 līdz 230 grādiem. Tā ir pamata aminoskābe, kas arī hidroksilizīnu saturošos proteīnus liek reaģēt bāziskos. Hidroksilizīnu atklāja amerikāņu bioķīmiķis un "Klīniskās ķīmijas" līdzdibinātājs Donalds Van Slyke (1883-1971).
Funkcija, efekts un uzdevumi
Hidroksilizīnam ir liela nozīme saistaudu struktūrā. Glikoproteīni satur arī hidroksilizīnu, lai veidotu proteīna glikozīdiskos savienojumus ar cukura atlikumiem uz hidroksilgrupas.
Kolagēna iekšienē tas ir atbildīgs par atsevišķu olbaltumvielu molekulu šķērssavienojumu. Kopā ar hidroksilprolīnu, prolīna hidrolizēto formu, tas ir arī noderīgs, veidojot kolagēna terciāro un kvartāra struktūru. Lizīna hidroksilēšanu katalizē enzīms lizilhidroksilāze, piedaloties kofaktoru dzelzs joniem un askorbīnskābei (C vitamīnam). Kolagēna hidroksilēto lizīna atlikumu sadalījuma shēma nav īpaši stingra un elastīga. Vienmēr ir atkārtotas shēmas.
Tomēr proteīnā ir arī veseli apgabali, kas nesatur hidroksilētas lizīna atliekas. Kamēr hidroksiprolīns ir atbildīgs par kolagēna spirālveida struktūru, sasaistot trīs olbaltumvielu ķēdes, caur hidroksilizīna hidroksilgrupām tiek izveidotas krusteniskās saites starp dažādām olbaltumvielu molekulām. Turklāt šīs molekulārās grupas kalpo arī kā glikozīdiskās saites ar cukuru saistīšanas vieta. Kopumā tas nodrošina saistaudu stiprību.
Ja proteīnos trūkst hidroksilizīna, to nevar novērst ar papildu aminoskābes uzņemšanu. Brīvajam hidroksilizīnam nav kodona, tāpēc to nevar iekļaut attiecīgajā proteīnā. Tāpēc uztura bagātinātāju ar pievienotu hidroksilizīnu vērtība ir ļoti apšaubāma. Tāpēc deficīta iemesls ir lizīna nepietiekama hidroksilēšana.
Izglītība, sastopamība, īpašības un optimālās vērtības
Hidroksilizīns ir atrodams tikai cilvēku un dzīvnieku kolagēnā. Ir arī daži glikoproteīni, kas satur arī hidroksilizīnu. Tas ietver adiponektīnu. Adiponektīns ir hormons, kas tiek ražots taukaudos un tam ir izšķiroša ietekme uz insulīna efektivitāti. Hidroksilizīns ir atklāts arī dažās baktērijās, piemēram, Staphylococcus aureus.
Hidroksilētā lizīna sadalījums kolagēnā nav vienmērīgs. Ir vietas, kur tas gandrīz vienmēr ir atrodams. Citās vietās hidroksilizīns gandrīz nekad nav atrodams. Šis nevienmērīgais sadalījums nosaka kolagēna struktūru. Kolagēna trīskāršās spirāles struktūrā hidroksilizīns vienmēr atrodas atkārtotās secības Gly-X-Y Y pozīcijā. Īsos reģionos ar spirālveida struktūru hidroksilizīns notiek arī citās vietās.
Slimības un traucējumi
Saistaudi ir absolūti atkarīgi no hidroksilizīna klātbūtnes. Kolagēns var būt stabils un stingrs tikai tad, ja darbojas proteīnu molekulu saiknes. Hidroksilizīna deficīts izraisa saistaudu vājumu.
Ja tas ir sastopams tikai ārkārtīgi mazos daudzumos vai vispār nav, attiecīgais organisms nebūtu dzīvotspējīgs. Saistaudi vairs nevarēja veikt savu uzdevumu kā orgānu ierobežojošie un atbalsta audi. Faktiski ir slimības, kuras var izsekot līdz hidroksilizīna trūkumam. Tā kā šī aminoskābe sākotnēji tiek iekļauta kā lizīns olbaltumvielu sintēzes laikā, tā nevar būt primārais deficīts. Hidroksilizīns no lizīna tiek veidots kolagēna proteīnā ar lizilhidroksilāžu palīdzību. Hidroksilizīna deficīts var rasties tikai šī fermenta defekta vai tā nepietiekamās funkcijas dēļ.
Pastāv neviendabīgu iedzimtu saistaudu vājumu grupa, kas pazīstama kā Ehlers-Danlos sindroms. Par šo klīnisko ainu var izraisīt vairākas mutācijas. Cita starpā lizila hidroksilāze var būt arī nepilnīga, tāpēc pārāk maz lizīna tiek hidroksilēta. Ehlera-Danlosa sindroms izpaužas kā ādas pārlieku elastīga un locītavu pārmērīga mobilitāte. Tiek ietekmēti arī iekšējie orgāni, asinsvadi, cīpslas, saites un muskuļi. Prognoze ir atkarīga no defekta nopietnības. Ja kuģi ir iesaistīti, ir sagaidāms nelabvēlīgs kurss. Pilnīga fermenta lizilhidroksilāzes mazspēja nav savienojama ar dzīvi, tāpēc tā netiek novērota.
Bet pat ar neskartu enzīmu zemas aktivitātes dēļ var būt vāji saistaudi. Lizilhidroksilāzei kā kofaktori nepieciešami dzelzs joni un askorbīnskābe (C vitamīns). Ja, piemēram, trūkst C vitamīna, rodas tā sauktais skorbuts. Smarža ir iegūta saistaudu slimība, ko izraisa hidroksilgrupu trūkums kolagēna prolīnam un lizīna atlikumiem. Cēlonis ir prolīna hidroksilāzes un lizīna hidroksilāzes zemā aktivitāte askorbīnskābes deficīta dēļ.



.jpg)










.jpg)