Hemoglobīna sintēze sastāv no hema sintēzes un globīna sintēzes. Visbeidzot, protezējošā hema grupa, katrā no tām ir četri globīni, ir saistīta ar dzelzi saturošu olbaltumvielu kompleksa hemoglobīnu. Traucējumi gan hema, gan globīna sintēzē var izraisīt nopietnas veselības problēmas.
Kas ir hemoglobīna sintēze?

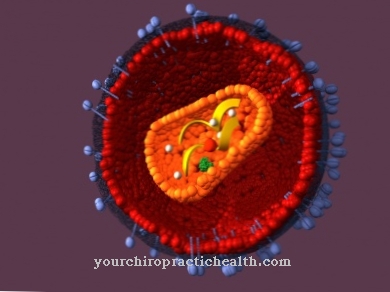
Lai izprastu hemoglobīna sintēzi, vispirms ir nepieciešamas zināšanas par hemoglobīna struktūru. Hemoglobīns ir dzelzi saturošs olbaltumvielu komplekss, kas sastāv no četrām globīna apakšvienībām, katrā no tām ir protezējoša hema grupa.
Pieaugušā cilvēka hemoglobīnā ir divi identiski alfa globīni, kā arī divi identiski beta globīni kā apakšvienības. Katra no šīm apakšvienībām ir saistīta ar protezējošu hemu grupu, kas sastāv no porfirīna dzelzs (II) kompleksa. Tādējādi hemoglobīna kompleksā ir četras hema grupas.
Atkarībā no ķīmiskās vides, katra hema grupa sarežģītā veidā var saistīt skābekļa molekulu ar melno jonu. Atkarībā no tā, cik hema grupas ir piekrautas ar skābekli, var runāt par oksihemoglobīnu (ar augstu skābekļa saturu) vai par deoksihemoglobīnu (ar zemu skābekļa saturu).
Melnais jons atrodas porfirīna gredzena vidū. Sānos ir sarežģīta saite ar globīna histidīna atlikumu. No otras puses, atkarībā no dzelzs jonu enerģijas stāvokļa, skābekļa molekulu var saistīt kompleksā. Enerģijas stāvokli ietekmē ārējie fizikālie un ķīmiskie apstākļi, mainoties globīna uzbūvei.
Funkcija un uzdevums
Pēdējais hemoglobīna sintēzes solis sastāv no protezēšanas hema grupas salikšanas ar četrām globīna vienībām, veidojot dzelzi saturošu olbaltumvielu kompleksu. Atsevišķos komponentus veido neatkarīgi biosintēzes ceļi.
Hēma grupas porfirīna gredzena izejmateriāli ir aminoskābes glicīns un sukcinil-CoA. Sukcinil-CoA sastāv no koenzīma A un dzintarskābes. Sukcīnskābe ir starpprodukts, kurā sadalās ar enerģiju bagāti ketonu ķermeņi kā daļa no enerģijas metabolisma. Ar enzīma delta-aminolevulīnskābes sintāzes palīdzību delta-aminolevulīnskābe tiek sintezēta no sukcinil-CoA un glicīna. Divas delta-aminolevulīnskābes molekulas kondensējas, izdalot vienu ūdens molekulu, veidojot pirfola atvasinājumu - porfobilinogēnu. Ar amonjaka izvadīšanu un ar enzīma uroporfirinogēna-I sintetāzes palīdzību četras porfobiliogēna molekulas reaģē, veidojot hidroksimetilbilānu. Tas tiek pārveidots par uroporfirinogēnu III ar gredzena veidošanos.
Protoporfirīns tiek iegūts enzīmu dekarboksilēšanas un dehidratācijas ceļā mitohondrijos. Kopā ar fermentu ferohelatāzi šajā molekulā tiek iesaistīts dzelzs (II) jons, veidojot hemu. Šūnas citosolā hems ir saistīts ar olbaltumvielu globīnu, veidojot dzelzi saturošu olbaltumvielu kompleksu hemoglobīnu.
Atsevišķu globīnu sintēze notiek ar normālu olbaltumvielu biosintēzi. Kā jau minēts, pieaugušo hemoglobīna komplekss satur divas identiskas alfa un beta globīnu apakšvienības. Sarežģītās struktūras dēļ gatavais hemoglobīns ir attīstījis spēju pārvadāt skābekli un piegādāt to visām organisma šūnām.
Tomēr centrālā dzelzs saistība ar skābekli nav ļoti cieša, un to ļoti viegli var ietekmēt ārējie ķīmiskie un fizikālie faktori. Tas ļauj hemoglobīnam gan ātri absorbēt, gan atbrīvot skābekli. Skābekļa saturs hemoglobīnā cita starpā ir atkarīgs no faktoriem pH, oglekļa dioksīda vai skābekļa parciālā spiediena vai temperatūras. Šie ietekmējošie mainīgie maina, piemēram, globīnu atbilstību, tā ka skābekļa saiti var stiprināt vai vājināt ar nelielām izmaiņām enerģētiskajos un steriskajos apstākļos.
Ar zemu pH vērtību un augstu oglekļa dioksīda daļēju spiedienu skābekļa saite ar dzelzs (II) jonu tiek vājināta, un tādējādi tiek veicināta skābekļa izdalīšanās. Tieši šādos apstākļos notiek spēcīgāka vielmaiņas apmaiņa, kurai arī ir palielināts skābekļa patēriņš. Tāpēc skābekļa transportēšanas sistēma ir optimāli koordinēta ar fiziskajām vajadzībām, izmantojot hemoglobīna funkciju.
Slimības un kaites
Traucējumi hemoglobīna sintēzē var izraisīt dažādas slimības. Pastāv vairākas ģenētiskas slimības, kuru pamatā ir hema sintēzes traucējumi. Procesa laikā ķermenī uzkrājas hema prekursori, kas cita starpā rada ārkārtēju gaismas jutīgumu. Šajās tā saucamajās porfīrijās porfirīni tiek glabāti asinsvados vai pat aknās. Dažas porfīrijas formas, nonākot pakļautas gaismai, uzkrāj vairāk starojuma enerģijas. Kad enerģija tiek atbrīvota, rodas skābekļa radikāļi, kas uzbrūk un iznīcina atklātos audus. Tas izraisa smagu niezi un dedzinošas sāpes.
Pastāv septiņas porfīra formas. Hēma uzbūve ir astoņu soļu process, kurā iesaistīti septiņi fermenti. Ja ferments darbojas tikai nepietiekami, attiecīgais prekursors šajā vietā tiek saglabāts hema sintēzē. Balstoties uz simptomiem, porfīrijas tiek sadalītas divās galvenajās grupās. Tā dēvētajām ādas porfīrijām raksturīga sāpīga ādas jutība pret gaismu. Aknu porfīrijas gadījumā aknu darbība galvenokārt notiek ar smagām vēdera sāpēm, nelabumu un vemšanu. Tomēr daudzos gadījumos abu simptomu kompleksi pārklājas.
Porfīrijas bieži parāda periodisku kursu ar akūtiem uzbrukumiem. Atkarībā no porfīrijas veida tās izpaužas kā pēkšņi sāpīgas ādas reakcijas, kolikveidīgas sāpes vēderā, slikta dūša / vemšana, urīna krāsa sarkanā krāsā, krampji, neiroloģiski deficīti vai pat psihozes.
Citi hemoglobīna sintēzes traucējumi ir saistīti ar nepareizu globīna molekulu sintēzi, veicot mutācijas attiecīgajos gēnos. Piemēri ir tā saucamā sirpjveida šūnu anēmija vai talasēmija. Sirpjveida šūnu anēmijas gadījumā beta globīna subvienības olbaltumvielas tiek ģenētiski modificētas. Šī proteīna sestajā pozīcijā aminoskābe glutamīnskābi ir aizstājusi ar valīnu. Ja trūkst skābekļa, attiecīgais hemoglobīns kļūst sirpjveida, salīp kopā un aizsērē mazos asinsvadus. Tā rezultātā rodas dzīvībai bīstami asinsrites traucējumi. Talasēmijas ir dažādu hemoglobīna anomāliju grupa, kas izraisa samazinātu alfa vai beta globīna globīna ķēdes veidošanos.Smaga anēmija ir vissvarīgākais simptoms.





.jpg)






.jpg)