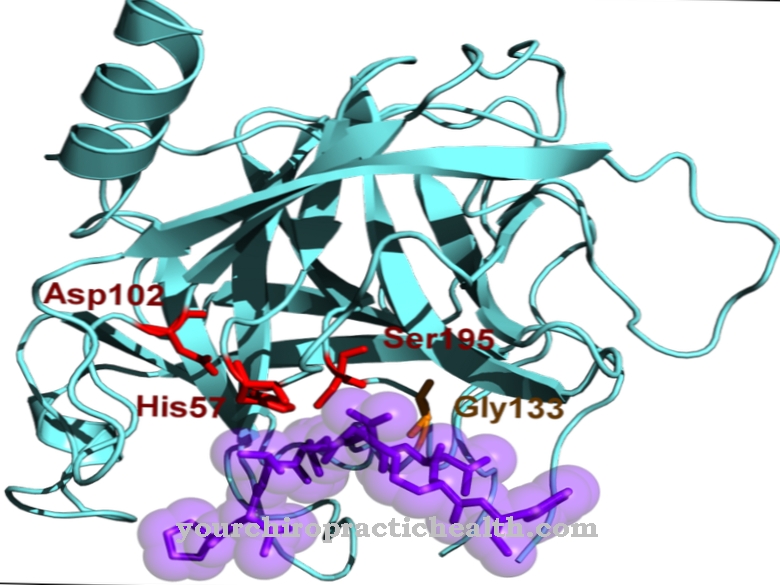
Liziloksidāze ir saistaudu enzīms, kam ir katalītiski uzdevumi un kas veicina kolagēna un elastīna šķērssavienojumu. Fermentam ir stabilizējoša iedarbība uz saistaudiem, veicot oksidatīvo deamināciju un tādējādi radot pamatnosacījumus šķērssavienojumam. Cutis laxa gadījumā tiek samazināta liziloksidāzes aktivitāte.
Kas ir liziloksidāze?
Cilvēka ķermenī ir dažādi fermenti, kuriem visiem ir katalītiskā aktivitāte. Fermenti ļauj reakcijas cilvēka ķermenī vai paātrina. Liziloksidāze ir enzīms, kas atrodams cilvēka saistaudos. To sauc arī par olbaltumvielu lizīna 6 oksidāzi, un to galvenokārt atrod saistaudu ārpusšūnu telpā.
Fermenta katalītiskā darbība šajā gadījumā attiecas uz kolagēna un elastīna šķērssavienojumu. Liziloksidāze mehāniskā veidā stabilizē abus proteīnus un tādējādi nodrošina reaktīvo savienojumu. Liziloksidāze ir atrodama ne tikai cilvēka ķermenī. Arī citi mugurkaulnieki ir aprīkoti ar enzīmu. Liziloksidāze tiek uzskatīta par saistaudu stabilizatoru. Fermenta deficīts noved pie cutis laxa klīniskā attēla, kas ir smags un iedzimts saistaudu vājums.
Funkcija, efekts un uzdevumi
Liziloksidāze veic svarīgus uzdevumus ārpusšūnu telpā, sadarbojoties atsevišķām kolagēna molekulām. Cilvēka ķermenī kolagēns spēlē galveno lomu olbaltumvielās - apmēram 30 procentus no kopējās olbaltumvielu masas.
Kolagēns ir visizplatītākais proteīns. Tas ir strukturāls un celtniecības proteīns, kas veido daudzas ķermeņa daļas, piemēram, saistaudus, kaulus, zobus, skrimšļus, cīpslas, saites un ādu. Liziloksidāze atbalsta kolagēna saistīšanos ar karbonilgrupām un tādējādi veicina minēto ķermeņa sastāvdaļu stabilitāti. Tam ir katalītiska darbība tādu karbonilgrupu ražošanā, kuras alvaolu kondensācijā veido kovalento šķērssaiti uz kolagēniem. Tāpēc liziloksidāzes katalītiskais uzdevums ir sagatavoties fibrilu veidošanai. Ferments rada visus ķīmiskos apstākļus, kas nepieciešami veidošanai.
Fibrillas tiek uzskatītas par šķiedru šķiedrām. Tie atbilst plānām un šķiedrainām ķermeņa daļām un ir atrodami augu šūnu sienās, cilvēka muskuļos un saistaudos. Liziloksidāzes uzdevums šajā kontekstā būtībā ir lizila atlikumu oksidatīvā deaminēšana. Ķīmijā deaminēšana ir ķīmiska aminogrupu sadalīšana kā amonija joni vai amonjaks. Oksidatīvā deaminācija no ūdeņraža sadala aminoskābes L-glutamāta aminogrupas un oksidē tās uz imino grupām, pārnesot ūdeņradi uz NAD + vai NADP +.
Tam seko imino grupu kā amonija jonu hidrolītiska šķelšanās, kas ir saistīta ar α-keto skābes veidošanos. Dezaminācija atbilst pirmajam aminoskābju bioķīmiskās sadalīšanās posmam, kas zīdītājiem galvenokārt notiek aknās. Amonija jonu, kas veidojas deaminācijas laikā, pārveido par urīnvielu. Liziloksidāzes dezaminācijas procesi rada aldehīdu grupas, kas ar citu lizilgrupu atsevišķām aminogrupām veido tā saucamās Šifa bāzes un šādā veidā var veidot stabilizējošas krusteniskās saites kolagēnā.
Izglītība, sastopamība, īpašības un optimālās vērtības
Liziloksidāzi DNS kodē LOX gēns, kas cilvēkiem atrodas 5. hromosomā gēna lokusā no q23.3 līdz q31.2. Gēna produkts nav fermenta galīgā forma. Produkts nav gatava liziloksidāze, bet gan priekšgājēja forma, kuras molārā masa pēc tulkošanas ir 47 kDa.
Glikozilācija notiek turpmākajā kursā. Šī procesa laikā vēlākā enzīma molārā masa palielinās līdz 50 kDa, un liziloksidāzes priekšgājēja forma tiek izdalīta ārpusšūnu telpā. Pēc sekrēcijas pre-liziloksidāzi apstrādā tālāk. Viela tiek sadalīta ārpusšūnu telpā. Olbaltumviela 1 ir atbildīga par sadalīšanu divos fragmentos.Tādā veidā, no vienas puses, tiek iegūta 32 kDa liziloksidāze. No otras puses, tiek izveidota paliekoša viela, kas šajā gadījumā atbilst polipeptīdam.
Slimības un traucējumi
Liziloksidāzes ģenētiski defekti var izraisīt cutix cax klīnisko ainu. Šo slimību sauc arī par dermatochalasis un attiecas uz saistaudu bieži ar vecumu saistītu vājumu grupu, kas vairumā gadījumu tiek novērota ar ģimenes uzkrāšanos.
Visām dermatochalasis parādībām ir raksturīga sagging un neelastīga āda, kas bieži uzkaras lielās krokās uz dažādām ķermeņa daļām. Izmaiņu dēļ lielākā daļa skarto cilvēku izskatās vecāki nekā viņi. Slimības cita starpā izraisa ģenētiskas mutācijas. Šajā kontekstā mēs runājam par cutis laxa sindromu. Slimība var pastāvēt autosomāli recesīvās, autosomāli dominējošās un x-hromosomālās formās. Daudzos gadījumos cutis laxa sindroms ir saistīts ar citām anomālijām, un, piemēram, ja orgāni ir iesaistīti, tas var būt letāls.
ARCL1 atbilst 1. tipa autosomāli recesīvā cutis laxa un tiek uzskatīta par smagāko formu, kas var izraisīt dzīvībai bīstamas komplikācijas. ARCL1A forma ir saistīta ar FBLN5 gēna mutācijām lokusā 14q32.12. ARCL1B tips ir saistīts ar mutācijām EFEMP2 gēnā lokusā 11q13.1, un ARCL1C variants atbilst cutis laxa ar pavadošām anomālijām plaušās, kuņģa-zarnu traktā un urīnceļos, kas rodas no LTBP4 gēna mutācijām lokusā 19q13.2.
Minēto gēnu mutācijas noved pie zemākas vidējās likoksilidāzes aktivitātes. Fermenta samazinātas aktivitātes dēļ tiek izveidoti nepietiekami šķērssavienojumi. Pacienta saistaudi nav pietiekami stabilizēti.









.jpg)